A Mathematical Model of the Liver Circadian Clock Linking Feeding and Fasting Cycles to Clock Function
A. Woller, H. Duez, B. Staels and M. Lefranc
Cell Reports 17, 1087-1097 (2016) [Accès à la revue]
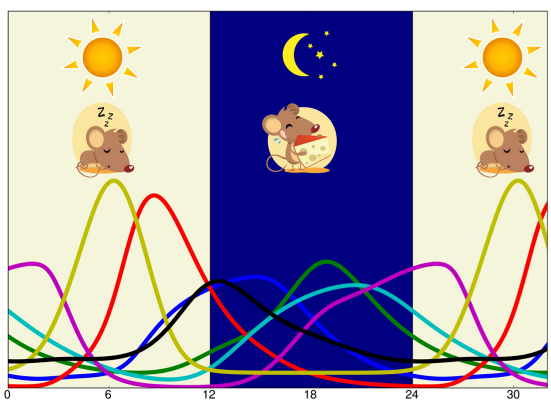
Comme beaucoup d'organismes, nous sommes soumis à une alternance de jours, où nous sommes actifs et où nous nous nourrissons et de nuits, où nous sommes au repos et où nous jeûnons. Pour anticiper ces variations journalières, notre physiologie est orchestrée par un réseau d'horloges biologiques situées dans les différents organes. Si notre horloge centrale, située dans le cerveau, est plutôt sensible aux variations de la lumière, les horloges périphériques, comme celle du foie, véritable régulateur du métabolisme, sont plutôt sensibles au rythme des repas. Nous avons construit le premier modèle mathématique décrivant comment l'horloge hépatique se synchronise aux variations de l'état métabolique des cellules. Ce modèle pourrait nous permettre de comprendre comment des perturbations de cette synchronisation peuvent dérégler l'horloge et mener à des pathologies comme l'obésité ou le diabète, et de proposer des protocoles chronothérapeutiques pour rétablir un fonctionnement normal de l'horloge dans de telles situations. Voir l'actualité scientifique de l'INP.
Abstract: To maintain energy homeostasis despite variable energy supply and consumption along the diurnal cycle, the liver relies on a circadian clock synchronized to food timing. Perturbed feeding and fasting cycles have been associated with clock disruption and metabolic diseases; however, the mechanisms are unclear. To address this question, we have constructed a mathematical model of the mammalian circadian clock, incorporating the metabolic sensors SIRT1 and AMPK. The clock response to various temporal patterns of AMPK activation was simulated numerically, mimicking the effects of a normal diet, fasting, and a high-fat diet. The model reproduces the dampened clock gene expression and NAD+ rhythms reported for mice on a high-fat diet and predicts that this effect may be pharmacologically rescued by timed REV-ERB agonist administration. Our model thus identifies altered AMPK signaling as a mechanism leading to clock disruption and its associated metabolic effects and suggests a pharmacological approach to resetting the clock in obesity.
Thème : Réseaux de signalisation et de régulation : processus et méthodologies
Equipe : Dynamique des réseaux biologiques (PhLAM)
