A dynamical model of oocyte maturation unveils precisely orchestrated meoitic decisions
B. Pfeuty, J.-F. Bodart, R. Blossey, and M. Lefranc
PLoS Computational Biology 8, e1002329 (2012) [Accès à la revue]
Cet article analyse le réseau d'interactions moléculaires contrôlant les évènements cellulaires se produisant lors de la maturation des ovocytes de Xénope. Cette maturation devant aboutir à une cellule contenant une seule copie du génome (l'autre étant apportée par le spermatozoïde), elle fait intervenir deux divisions successives, sans réplication de l'ADN entre temps (on parle alors de méiose). Suite à la stimulation par la progestérone, l'ovocyte enclenche une première division, puis une deuxième où il s'arrête juste avant la phase de séparation des chromosomes, en attendant la fertilisation. Cette progression est associée à un profil temporel caractéristique de l'activité du MPF (mitosis promoting factor), qui présente un premier pic, redescend puis remonte à un niveau élevé. Dans cet article, nous montrons que la transition s'effectue de manière robuste, et comment l'activation successive de différentes boucles de rétroaction permet de réaliser la dynamique complexe observée pendant la maturation.
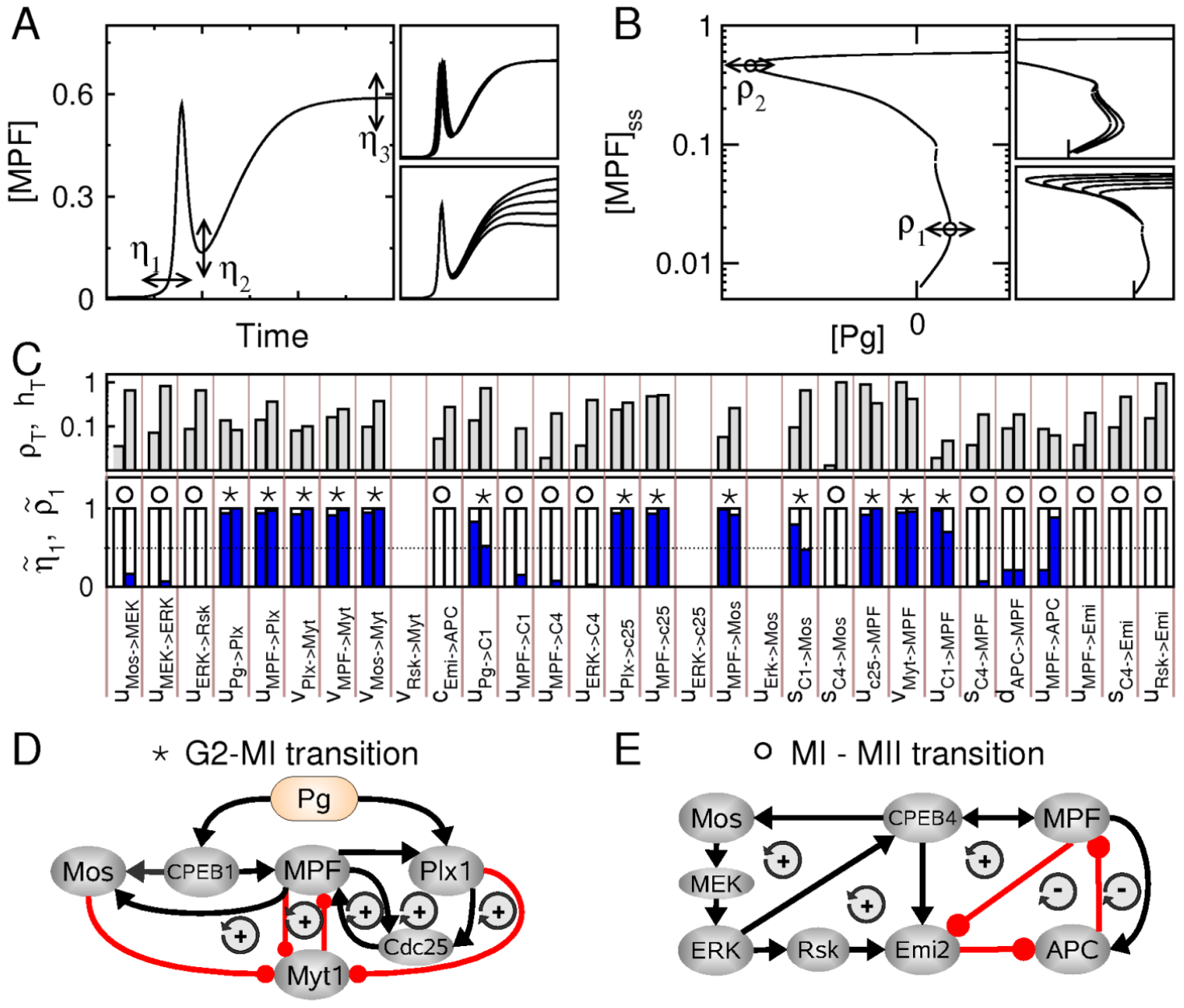
Abstract: Maturation of vertebrate oocytes into haploid gametes relies on two consecutive meioses without intervening DNA replication. The temporal sequence of cellular transitions driving eggs from G2 arrest to meiosis I (MI) and then to meiosis II (MII) is controlled by the interplay between cyclin-dependent and mitogen-activated protein kinases. In this paper, we propose a dynamical model of the molecular network that orchestrates maturation of Xenopus laevis oocytes. Our model reproduces the core features of maturation progression, including the characteristic non-monotonous time course of cyclin-Cdks, and unveils the network design principles underlying a precise sequence of meiotic decisions, as captured by bifurcation and sensitivity analyses. Firstly, a coherent and sharp meiotic resumption is triggered by the concerted action of positive feedback loops post-translationally activating cyclin-Cdks. Secondly, meiotic transition is driven by the dynamic antagonism between positive and negative feedback loops controlling cyclin turnover. Our findings reveal a highly modular network in which the coordination of distinct regulatory schemes ensures both reliable and flexible cell-cycle decisions.
Thème : Modélisation et dynamique
